海思科创新药HSK29116美国IND获FDA许可
近日,海思科创新药HSK29116美国IND获FDA许可,本次临床试验是评价BTK蛋白降解剂HSK29116在复发或难治性B细胞恶性肿瘤受试者中的安全性、耐受性和药代动力学/药效学。
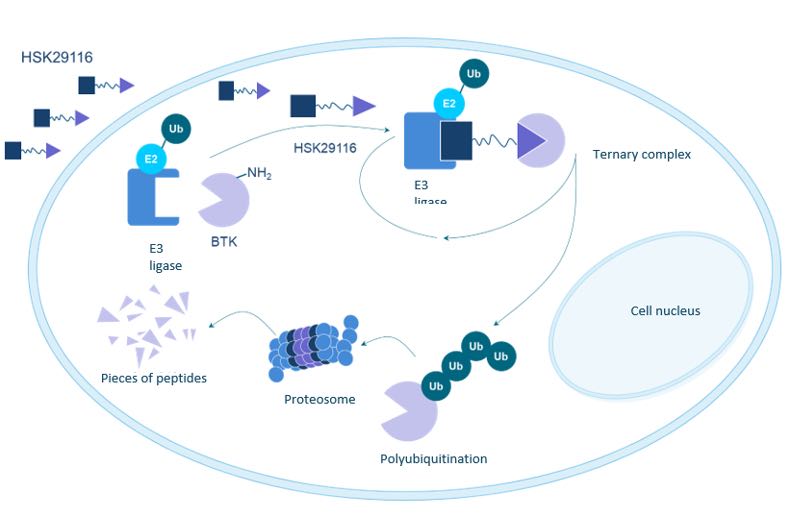
HSK29116是海思科自主研发的靶向BTK的口服PROTAC小分子抗肿瘤药物,用于治疗复发难治B细胞淋巴瘤,是国内首款、全球第二款进入临床研究的BTK-PROTAC药物。
作用机制图
HSK29116已于2021年4月获得NMPA批准开展临床,目前国内和澳大利亚的临床剂量爬坡试验正在快速推进中,已开展到第四个剂量组,进展良好。美国临床将作为其全球多中心研究的重要组成部分,即将正式启动I期临床试验。
HSK29116是海思科基于领先的Protac研发平台研发出的国内首个申报临床的Protac药物,用于治疗B细胞淋巴瘤。HSK29116可选择性的阻断BTK激酶活性、通过调节信号通路干预B细胞发育,从而控制各种B细胞恶性肿瘤的进展。HSK29116一方面可通过特异性结合BTK直接抑制BTK活性;另一方面能诱导BTK泛素化标记,通过蛋白酶体途径将其降解,从而阻断BCR信号通路的传递,抑制B细胞淋巴瘤细胞的生长与增殖,起到双重抗肿瘤作用。不仅对野生型BTK有更好的药效,同时可克服耐药突变问题。
e公司声明:文章提及个股及内容仅供参考,不构成投资建议。投资者据此操作,风险自担。









